Introduction
(1)蛋白質凝集とは?
蛋白質はアミノ酸が重合してできる生体高分子で、数十~数百のアミノ酸がペプチド結合を介してビーズのようにつながっています。 このポリペプチド鎖が折り畳まれることで特定の立体構造を形成すると、様々な生理活性を発揮します(例:ホルモン、酵素、受容体)。
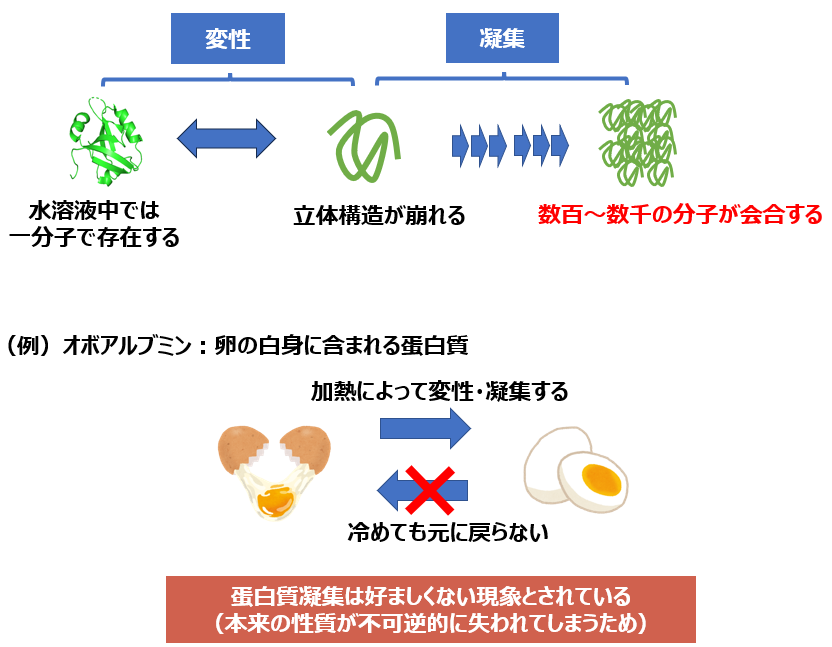
ところが蛋白質の構造安定性はごく僅かで、熱・pH・圧力などのストレスによって立体構造は容易に崩れてしまいます(=蛋白質の変性)。 さらに変性した蛋白質同士は、分子表面に露出した疎水性領域を介して、不可逆的に会合しやすくなります(=蛋白質の凝集)。
蛋白質凝集は、基本的には不可逆的な反応なので、一度起きてしまうと元には戻らないことが多いです。 例えば生卵をフライパンで加熱すると目玉焼きになりますが、それを冷蔵庫で冷やしても生卵には戻りません。 この不可逆的な反応は、卵白に含まれる蛋白質(オボアルブミン・リゾチームなど)が熱によって変性・凝集したのが原因と考えられます。
バイオ産業では、産業用酵素・抗体医薬品・バイオマテリアルといった蛋白質製剤の市場価値は年々高くなっていますが、 その一方で蛋白質凝集が原因とされる生理活性の低下・免疫原性の増加など、品質低下のトラブルも懸念されています。 そのため、蛋白質製剤の品質管理において、蛋白質の熱安定性・溶解性・会合状態といった物性評価は重要なプロセスと言えます。
(2)可逆的なオリゴマー(RO)とは?
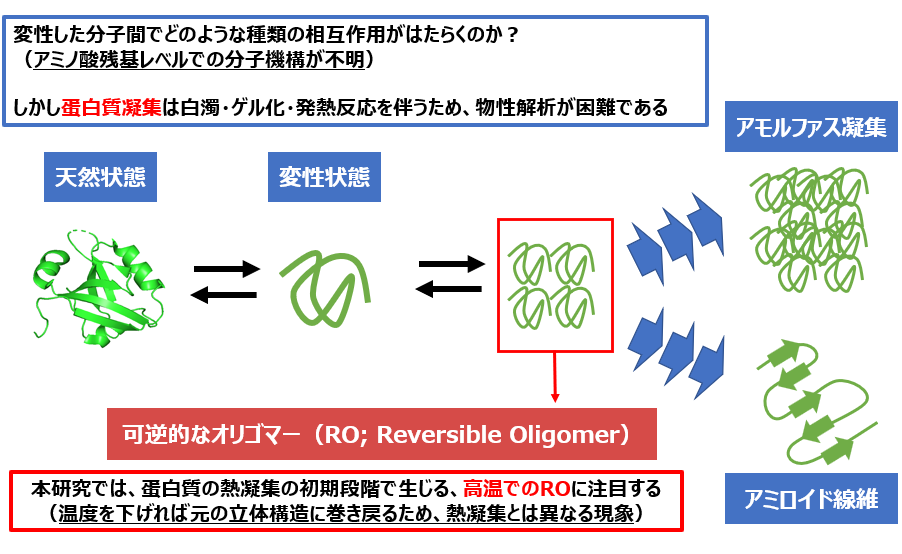
変性した蛋白質が数百~数千分子で会合することで、蛋白質凝集が形成されます。 蛋白質凝集の構造に注目すると、不定形の「アモルファス凝集」とcross-β構造の「アミロイド線維」の2種類に分類されます。 このうちアミロイド線維は細胞毒性が高く、アルツハイマー病・パーキンソン病など神経変性疾患の原因とされており、医学的にも重要な研究対象とされています。
ところが蛋白質凝集は溶液の白濁・ゲル化・急激な発熱反応を伴うため、熱測定や分光測定でそのまま解析するとノイズが非常に大きく、物性や構造の解析は非常に難しいとされてきました。 その一方で、変性した蛋白質が2~10分子程度で会合した状態であれば、1分子へと可逆的に解離するため、平衡論的な解析が可能であると判明しました。この状態は「可逆的なオリゴマー(RO; Reversible Oligomer)」と呼ばれ、熱変性した蛋白質が高温でROを形成しても、温度を下げれば1分子に解離して立体構造も巻き戻るため、不可逆的な熱凝集とは似て非なる現象と考えられます。
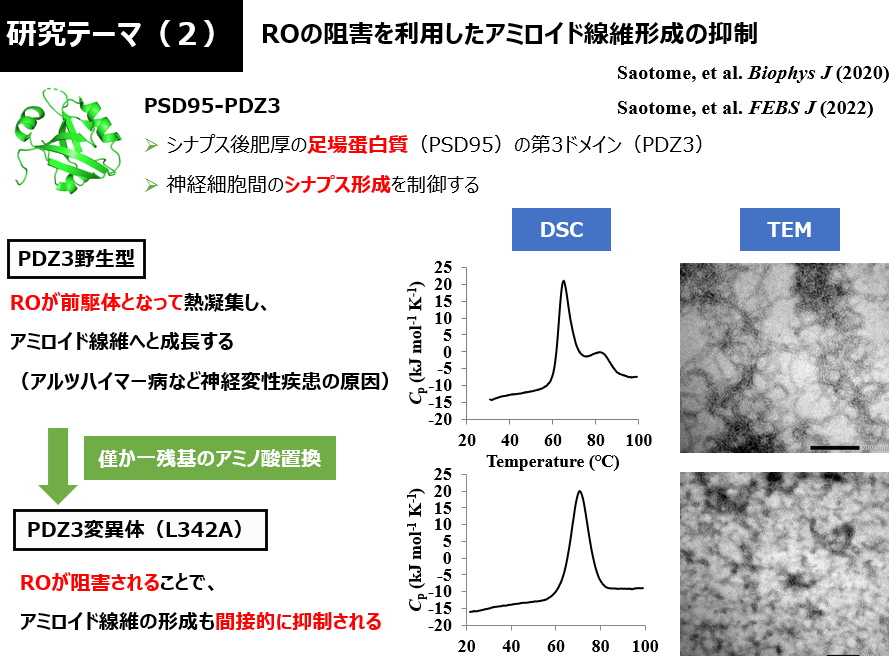
ROに関して物理化学的性質や立体構造など不明な点は多いですが、これまで自身が行ってきた研究では、「僅か一残基のアミノ酸置換によってRO形成を阻害できる」「ROを阻害することでアミロイド線維形成も抑制可能である」ことが明らかになりました。 現時点では数種類の小型球状蛋白質で得られた限定的な知見に過ぎませんが、これからも多くの種類の蛋白質で同様の検証を重ねることで、ROはあらゆる蛋白質で起こりうる普遍的な現象であると証明していく予定です。
Project Theme
当研究室では、大腸菌を培養して組換え蛋白質を発現・精製し、熱測定や分光測定を行うことで、蛋白質の物性を定量的に評価します。 また少数のアミノ酸変異を導入することで、蛋白質の構造・機能など本来の性質は大きく変えずに、凝集傾向性だけを低下させる分子設計法の開発も目指しています。
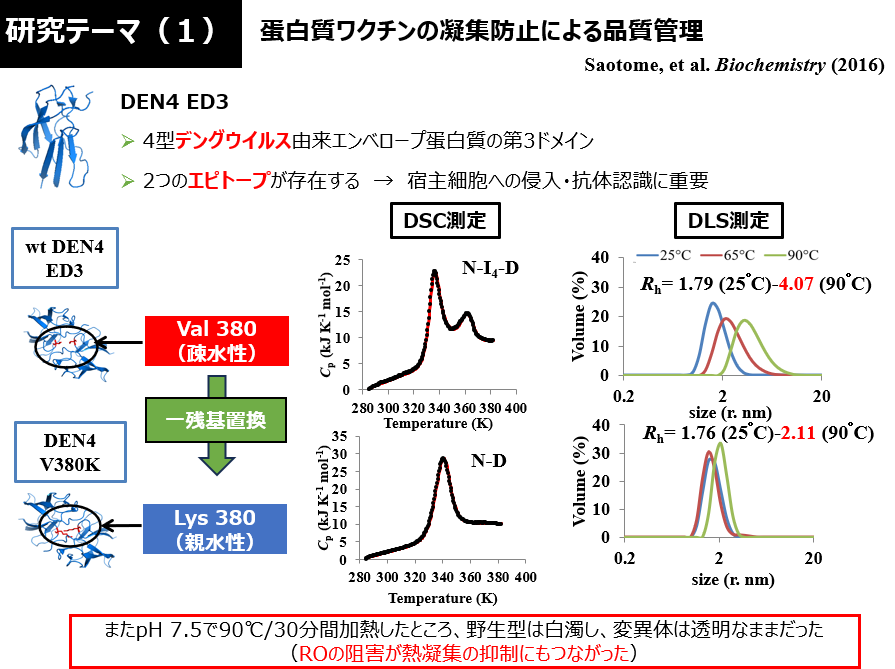
研究テーマ(1):蛋白質ワクチンの物性解析
- ウイルス由来の抗原蛋白質の熱安定性を定量的に評価する
- 例:デングウイルス・コロナウイルス・インフルエンザウイルス (エンベロープ蛋白質やスパイク蛋白質のドメイン断片を用いる)
研究テーマ(2):蛋白質凝集を抑制するための分子設計法の開発
- 熱凝集の初期段階で見られる可逆的なオリゴマー(RO; Reversible Oligomer)
- 僅か一残基のアミノ酸置換でROを阻害し、アミロイド線維・アモルファス凝集の抑制を目指す
- 例:DEN4 ED3, PSD95-PDZ3など (これらのシングルドメイン蛋白質で、熱凝集の抑制に成功している)