実験番号9
「硫酸アンモニウム鉄(II)中の
鉄の定量」
(テキストp67~p69)
目的:約0.02mol/L 過マンガン酸カリウム標準液を用いて滴定し、
硫酸アンモニウム鉄(II)の鉄の含有率を求める。また、試料の純度を求める。
実験のポイント
「過マンガン酸カリウムを用いた鉄の定量法」
Key words:酸化還元反応、酸化還元滴定、酸化剤、還元剤、過マンガン酸カリウム滴定
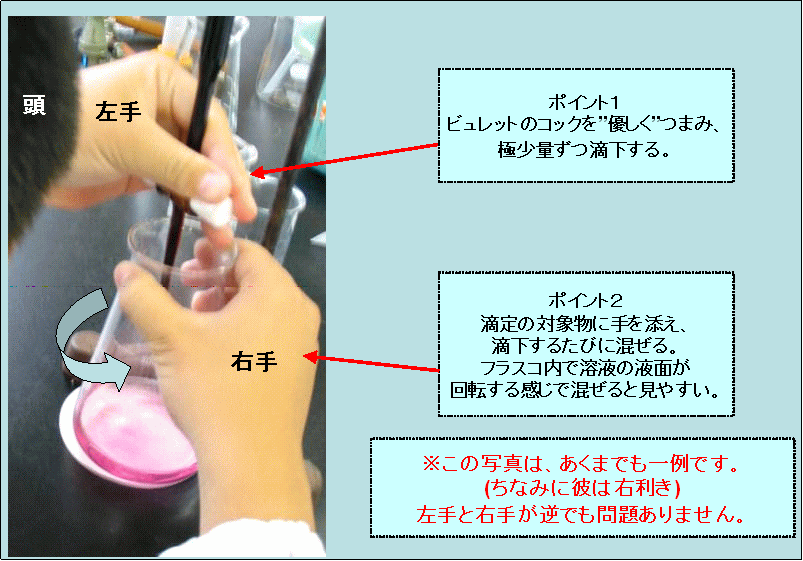
| 実験を行う上で観察して欲しいところや注意事項 | |
| ① | 濃硫酸は必ずドラフト内で、保護メガネを着用して扱って下さい。危険です!!! |
| ② | 過マンガン酸カリウム溶液の保存には、何故褐色瓶が使用されるのか考えましょう。 |
| ③ | 色の変化を見やすくするために、白い紙をひいて滴定を行いましょう。 |
| レポートを書く上で必ず調べて欲しい事項 | |
| ① | 理論値を計算し、自分の得たデータと比較してみましょう。 もし違っていたら、その原因について考えてみましょう |
| ② | 「モール塩」について調べてみましょう。 |
| ③ | 硫酸アンモニウム鉄(II)水溶液が加水分解するとどうなりますか。反応式を用いて考えてみましょう。 |
| ④ | Fe3+イオンによる着色とはどのような反応でしょうか。反応式を用いて考えてみましょう。 |
| ⑤ | 鉄イオンの性質を調べ、実験中に観察できたことと比較して説明してみましょう。 |
| ⑥ | 操作フローチャートに、「ひょう量びんの内側を洗い、その洗液もメスフラスコに入れる」とありますが、 何故そのような操作が必要なのでしょうか。 |
| ⑦ | 「風解」について調べてみましょう。 |
| その他の問題 (図書館などで調べてみましょう) | |
| ① | 今回の分析法は、どのような用途(実用例)が考えられますか。 |
| Q&A(過去のレポートより) |
| Q1:酸化還元反応が良くわかりません。 A1:実験テキストより、チャート式などの参考書を読んでみてください。 |
さっきのページへもどる